FDA схвалило препарат для затримки розвитку цукрового діабету 1 типу
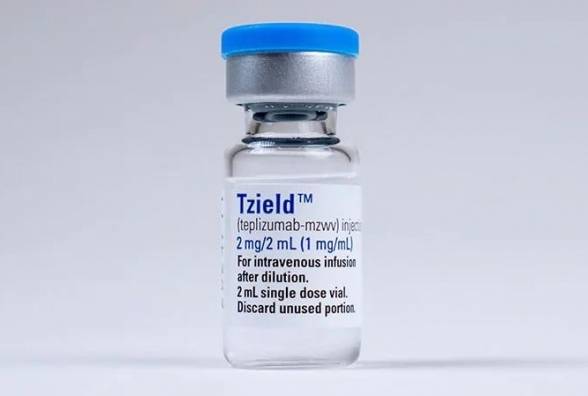
Управління з санітарного нагляду за якістю харчових продуктів і медикаментів США (FDA) у четвер (17.11.22) схвалило препарат Tzield (Teplizumab) — імунотерапію компанії Provention Bio, призначену для затримки розвитку цукрового діабету 1 типу (ЦД 1).
- Автор: Анастасія Цвігун, редакторка
- access_time
Tzield (Teplizumab) є першою схваленою терапією, показаною для затримки прогресування ЦД 1 у деяких людей з високим ризиком розвитку захворювання. Препарат схвалений для лікування дорослих та дітей віком від 8 років.
Teplizumab вводиться шляхом внутрішньовенної інфузії один раз на добу протягом 14 днів поспіль.
«Потенціал препарату затримувати клінічну діагностику цукрового діабету 1 типу може забезпечити пацієнтам від декількох місяців до декількох років без тягаря хвороби», — говорить доктор Джон Шарреттс (John Sharretts), директор Відділу діабету, ліпідних розладів та ожиріння Центру оцінки та досліджень лікарських засобів Управління з контролю за якістю харчових продуктів і медикаментів США (FDA).
Що нам відомо
Teplizumab зв'язується з певними клітинами імунної системи і затримує прогресування ЦД 1. Терапія може деактивувати імунні клітини, які атакують бета-клітини, що виробляють інсулін, одночасно збільшуючи частку клітин, які допомагають пом'якшити імунну відповідь, по суті стабілізуючи функцію бета-клітин.
Аутоантитіла — це антитіла, що виробляються вашою імунною системою, які атакують ваші власні тканини і часто пов'язані з аутоімунними реакціями. Аутоантитіла, пов'язані з ЦД 1, можуть виявлятися в аналізах крові за місяці або роки до появи фізичних симптомів, які зазвичай призводять до постановки діагнозу.
Клінічні дослідження Teplizumab були зосереджені на учасниках, у яких вже спостерігалося зниження рівня С-пептиду, що означало, що вироблення інсуліну та функція бета-клітин вже зазнавали впливу.
Середній час від вступу в дослідження до початку фактичного діагностування діабету ЦД 1 становив 50 місяців у групі, яка отримувала Teplizumab, порівняно з 25 місяцями у групі, яка не отримувала терапію.
У 2019 році FDA присвоїло Teplizumab звання «Проривна терапія» після того, як він став першим препаратом, який успішно продемонстрував затримку початку ЦД 1.
Цей статус надається препаратам для лікування серйозних або загрозливих для життя станів, клінічні випробування яких продемонстрували значні переваги над існуючими методами лікування. В рамках цієї програми виробник лікарського засобу може отримати гарантовану підтримку від Управління з контролю за якістю харчових продуктів і медикаментів США.
Чому це важливо
Більше часу зі збереженою гормональною функцією та стабільним рівнем цукру в крові означає менше навантаження на організм, спричиненого коливаннями рівня цукру в крові. Відтермінування початку ЦД також означає менше часу, витраченого на управління захворюванням та зменшення його ризиків і ускладнень.
«Це історична подія для спільноти людей із цукровим діабетом 1 типу і прорив у зміні парадигми для людей із високим ризиком розвитку захворювання у віці від 8 років і старше, які тепер мають терапію, схвалену FDA для затримки початку хвороби», — сказав співзасновник і генеральний директор Provention Bio Ешлі Палмер (Ashleigh Palmer).
Уповільнення втрати функції бета-клітин має й інші довгострокові переваги. Активний моніторинг рівнів аутоантитіл та інших маркерів ЦД у людей, які отримують це профілактичне лікування, дозволяє мінімізувати ризик або навіть запобігти діабетичному кетоацидозу (ДКА).
ДКА є небезпечним для життя ускладненням діабету, що часто призводить до госпіталізації. Багато вперше діагностованих осіб перебувають у стані ДКА на момент встановлення діагнозу ЦД, у тому числі до 40% вперше діагностованих дітей.
Уникнення ДКА є життєво важливим, а ДКА на момент встановлення діагнозу асоціюється з гіршими довгостроковими наслідками, пов'язаними з цукровим діабетом.
Чи допоможе Teplizumab зберегти функцію бета-клітин?
Поточне дослідження PROTECT, яке планується завершити у травні 2023, вивчає, чи зберігає Teplizumab функцію бета-клітин у дітей з нещодавно діагностованим ЦД 1.
У дослідженні візьмуть участь 300 учасників віком від 8 до 17 років, у яких на момент реєстрації був діагностований ЦД 1 протягом останніх шести тижнів. Учасники отримають два 12-денних курси лікування препаратом Teplizumab з інтервалом у шість місяців.
Що далі...
Міжнародна фармацевтична компанія та виробник інсуліну Sanofi отримала право на проведення перших переговорів щодо ексклюзивних глобальних прав на дослідження, розробку та комерціалізацію препарату Teplizumab в рамках угоди з компанією Provention Bio.
Позитивні результати дослідження PROTECT можуть призвести до того, що Teplizumab буде схвалений для більш широкого застосування.
***Джерела: beyondtype1.org, fda.gov
Читайте нас в Instagram: @saharok_journal та Telegram: t.me/saharok_journal
«Тихий вбивця»: чим небезпечний високий рівень тригліцеридів при діабеті, та як його знизити
Гіпонеусвідомленість: 5 способів захистити себе, якщо ви не відчуваєте симптомів низького цукру
Лікування діабету за допомогою пробіотиків та синбіотиків. Що показало нове дослідження?
4 найгірші продукти для сніданку, якщо у вас діабет або переддіабет
Електронні сигарети та вейпи — чи безпечні вони для людей з діабетом?
Автономна нейропатія шлунку та її вплив на компенсацію діабету
7 солодких продуктів, які можна їсти при діабеті
«Діабет мене не зупинить!» Спортсмен з Британії про свій діагноз, світовий рекорд та допомогу українцям
Контроль цукрового діабету з DIA.SCHOOL
9 способів попіклуватися про себе при діабеті

Моя Цукрова Школа від 14 лютого 2024
Читати номер












Ви не авторизовані